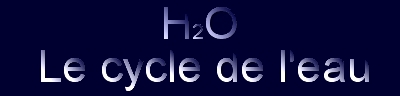LA MOLECULE
D'EAU : H2O
Qu'est-ce
qu'une molécule d'eau ?
La molécule est le plus petit fragment "possible"
d'un corps donné. Elle conserve donc toutes les propriétés
physiques et chimiques de celui-ci. Ainsi, en ce qui concerne l'eau,
atteint-on par divisions successives ce "grain" ultime : la
molécule d'eau.
Celle-ci a une dimension de l'ordre de 0,0000000001 mètre, soit
0,00000001 cm.
La molécule n'est pas une boule. Sa forme ressemble à
une tête de Mickey.
Les deux petites "boules" sont des atomes d'hydrogène,
la plus grosse est un atome d'oxygène. Ces atomes sont liés
entre eux par des forces électrostatiques importantes.
La liaison
hydrogène :
Chaque goutte d'eau contient plusieurs milliards de molécules
d'eau, reliées les unes aux autres par leurs pôles, chargés
électriquement : un pôle chargé négativement
(les atomes d'hydrogène) et un pôle chargé positivement
(l'atome d'oxygène).
En présence les unes des autres, les molécules vont se
comporter comme de petits aimants, les pôles positifs et négatifs
s'attirent réciproquement : chaque atome d'oxygène va
chercher à se rapprocher d'un atome d'hydrogène et vice-versa.
Les molécules d'eau sont donc liées par ce que l'on appelle
une liaison hydrogène, cette liaison étant assurée
par les atomes d'hydrogène. Cette liaison entre chaque molécule
d'eau forme une sorte de réseau sans cesse changeant et modulable.
En effet, si l'union à l'intérieur même d'une molécule,
est très stable, il n'en est pas de même en ce qui concerne
les liens entre les molécules. Ces dernières sont à
la fois très proches et très libres, elles se lient entre
elles et se défond toute aussi rapidement, elles "roulent"
les unes sur les autres, changeant sans cesse leur ordonnancement. Cette
liaison hydrogène est donc plus faible que celle qui soude entre
eux les trois atomes de la molécule, mais cependant suffisamment
forte pour expliquer les propriétés exceptionnelles de
l'eau. L'attirance électrique entre atomes, même au sein
de deux molécules distinctes, est forte. Un atome d'hydrogène
d'une molécule peut ainsi être capté par l'atome
oxygène d'une autre molécule. On n'a alors plus deux molécules
H2O mais d'un côté un ion HO- et
de l'autre côté un ion H3O+.
Ce ne sont plus, en effet, des molécules mais des ions dont les
charges s'annulent : l'eau est électriquement neutre.
Haut de page

L'eau est un corps dont l'unité de base est une molécule
: la molécule d'eau. Celle-ci est formée d'un atome
d'oxygène relié à deux atomes d'hydrogène.
On la note H2O, le H
symbolisant les atomes d'hydrogène et le O
l'atome d'oxygène.
 Ci-contre les représentations spatiale de la molécule
d'eau
Ci-contre les représentations spatiale de la molécule
d'eau
 En rouge la molécule d'oxygène
et en gris les molécules d'hydrogène
En rouge la molécule d'oxygène
et en gris les molécules d'hydrogène
En première analyse, tous les atomes sont formés
d'un noyau dense, porteur d'une charge électrique positive
autour de laquelle gravitent des électrons, particules élémentaires,
porteuses d'une charge électrique négative.
L'atome d'hydrogène est le plus petit de tous. Il ne possède
qu'un seul électron.
La présence des électron est primordiale car ce sont
eux qui permettent de fixer les atomes entre eux. La liaison chimique
( symbolisée par une barre reliant les deux atomes ) est assurée
par la mise en commun d'un ou plusieurs atomes.
Ce partage entre atomes n'est pas toujours équitables et il
arrive que certain atomes soit plus avides d'électron que d'autres.
C'est ce qui se passe dans la molécule d'eau : en effet l'atome
d'oxygène capte plus d'électrons que l'atome d'hydrogène.
Ainsi, l'atome d'oxygène est chargé négativement
et l'atome d'hydrogène est chargé positivement. La molécule
d'eau s'en retrouve polarisée ; on dit d'elle qu'elle est polaire.
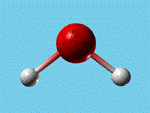
Deux représentations de la molécule d'eau.(lll. R.
Bichac)
Ces deux représentations sont très schématiques
et ne permettent pas d'appréhender la manière dont les
atomes sont répartis au sein de la molécule.
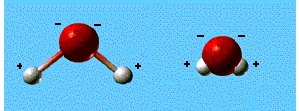
En revanche, la représentation suivante est le résultat
d'un calcul rigoureux effectué par des scientifiques, montre
les régions au sein desquelles la probabilité de trouver
une seule paire d'électron est la plus grande. Car il faut
savoir que la molécule d'eau possède au total dix électrons
dont huit proviennent de l'atome d'oxygène, les deux autres
provenant des deux atomes d'hydrogène.
Les lobes bleus figurent les domaines où se situent préférentiellement
les paires d'électrons qui assurent les liaisons oxygène-hydrogène
au sein de la molécule (une paire pour chaque liaison).
La sphère rose matérialise le domaine des deux électrons
''de cœur''.
Enfin, le domaine orangé correspond aux quatre derniers de
l'atome d'oxygène groupés par paire. Ces électrons,
dits ''libres'', sont très importants car ils permettent la
formation des fameuses liaisons hydrogène.
By SosO.
Haut de page
Pour me contacter : prfabien@caramail.com